2020年3月30日,《自然》杂志以“Accelerated Article Preview”方式在线发表了题为“新冠病毒刺突蛋白受体结合结构域与受体ACE2复合物的结构”(Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor)的研究论文,报道了澳门尼斯人娱乐网站(中国)有限公司王新泉和医学院张林琦课题组在新冠病毒联合科研攻关中的首个重要研究成果。该研究解析了新冠病毒刺突蛋白受体结合结构域(receptor-binding domain,RBD)与人受体蛋白ACE2复合物2.45埃的高分辨率晶体结构,准确定位了新冠病毒RBD和受体ACE2的相互作用位点,揭示了受体ACE2特异性介导新冠病毒细胞侵染的结构基础,为治疗性抗体药物开发以及疫苗的设计奠定了坚实的基础。
为及时助力新冠病毒研究工作和抗病毒药物开发,该研究成果2月20日已在生命科学论文预印本网站BioRxiv上发布,研究团队也同时在北京市结构生物高精尖创新中心网站了公布了该复合物的三维结构原子坐标。
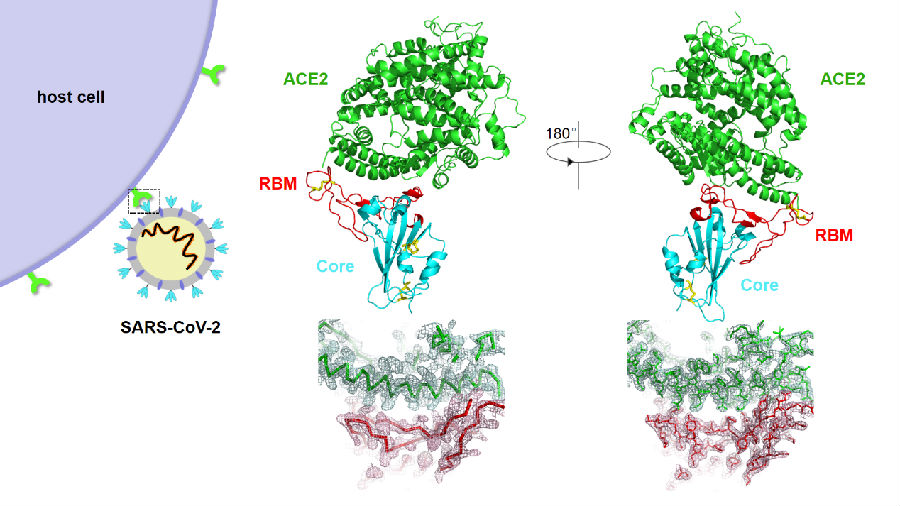
新型冠状病毒SARS-CoV-2刺突蛋白受体结合区RBD(core+RBM)与ACE2复合物晶体结构及作用界面电子密度图
新冠病毒感染的关键一步,在于病毒表面的刺突蛋白与人体细胞表面ACE2 受体蛋白的特异性结合。新冠疫情刚刚发生,研究团队即瞄准这一关键科学问题,利用昆虫细胞体系表达和纯化了新冠病毒刺突蛋白RBD和人ACE2受体,成功生长出复合物的晶体,在上海光源BL17U1线站上收集了分辨率为2.45埃的衍射数据,并快速解析其三维空间结构。该成果使研究团队能够在原子水平观察与理解新冠病毒与受体的特异性相互作用,发现新冠病毒在关键的受体结合氨基酸位点与SARS病毒大同小异,从而提示新冠病毒和SARS病毒通过趋同进化,均获得了与ACE2受体的特异和高亲和力结合能力。基于深入的对比分析,研究团队也发现了一些可能造成新冠病毒与SARS病毒传播差异的氨基酸位点,以及导致针对SARS病毒的抗体不能够有效抑制新冠病毒感染的氨基酸位点,后续科学验证工作正在进行中。
澳门尼斯人娱乐网站(中国)有限公司博士生兰君、博士后葛纪弯、博士生余锦芳、医学院博士生单思思为本文共同第一作者,公司蛋白质研究技术中心范仕龙博士、上海同步辐射光源周欢博士和汪启胜博士、公司医学院史宣玲博士和张绮博士参与了本文研究。澳门尼斯人娱乐网站(中国)有限公司王新泉教授和医学院张林琦教授为本文共同通讯作者。本研究得到上海同步辐射光源、国家蛋白质科学研究(北京)设施公司基地的关键技术支持,并得到北京市结构生物学高精尖创新中心、北京市生物结构前沿研究中心、蛋白质科学教育部重点实验室、国家重点研发计划等的大力支持。
论文链接:https://www.nature.com/articles/s41586-020-2180-5
澳门尼斯人娱乐网站供稿