2020年2月10日,PNAS杂志以最新论文(Latest Article)的形式在线发表了由澳门尼斯人娱乐网站姚骏课题组和美国索尔克研究所的弗雷德?盖奇(Fred Gage)课题组合作完成的题为“Synaptotagmin-7 (Syt7) 是小鼠中产生双相样精神行为异常的关键因素”(Synaptotagmin-7 is a key factor for bipolar-like behavioral abnormalities in mice) 的研究论文,系统阐述了他们在精神疾病研究中构建的全新思路, 并报道了他们根据这一架构在双相情感障碍发病机理研究中取得的进展,为该病发病机理的深入研究开辟了道路。
双相情感障碍和其它主要精神疾病(例如精神分裂症、自闭症等)相比,目前基于易感基因和环境压力的动物模型尚无一个能够表现出该病的核心症状,即躁狂和抑郁情绪的交替发作,因而,领域内对双相情感障碍机理的深入了解,长期以来几乎陷于停滞。易感基因在动物模型上的验证失败,也被认为是支持双相障碍(和其它精神疾病)的多基因致病假说的主要证据。
姚骏课题组在前期工作中,采用诱导多能干细胞技术对双相障碍病人的海马神经元进行了转录组和功能分析,发现了散发型病人尽管遗传缺陷各不相同,但是分子和细胞水平缺陷却高度一致的现象。因而,该类疾病的高遗传率可能在于某一条关键分子机制出现障碍并能够稳定遗传。基于这一分析,姚骏课题组提出解释双相障碍致病的树型机理假说(图一A),从三个层面推导了双相障碍发病的可能机理:1)在分子层面,某条给定的分子机制的缺陷是发病和遗传的枢纽;2)在神经环路层面,该分子通路缺陷在不同脑区和不同亚型神经细胞中起作用,综合形成高度复杂但又高度一致的双相行为表型;3)在遗传学层面,易感基因虽然各自功能不同,但最终都会通过某种方式影响该分子通路。基于这一模型,课题组将寻找假定关键的分子机制缺陷作为进一步研究的突破口。
精神疾病的另一大特点是它往往与外周疾病并发。双相障碍的主要外周并发症是心血管疾病和糖尿病。虽然双相障碍人群的糖尿病发病率只有10%,仅比正常人群的糖尿病风险高两倍,但是有胰岛素代谢异常的病人比例却高达40%。因此,课题组进一步假设:该分子机制的缺陷可能在双相情感障碍和代谢障碍中同时起关键作用,在脑中可能引发精神行为异常,在外周则可能引起代谢异常。重要的是,相对于精神疾病而言,学术领域对外周疾病的了解要透彻地多。为寻找假定关键的分子机制缺陷,课题组将目前已知的胰岛素代谢和糖尿病相关基因与双相病人神经元的转录组测序结果加以对比,将疑似基因的数量缩减到11个(图一B)。通过在小鼠脑中进行11个基因的敲低和行为学排查,课题组发现Syt7基因敲低可引起小鼠精神行为异常,因而是双相障碍发病的一个风险因子。接下来,课题组对12个双相障碍病人的干细胞分化神经元、20个病人的血液样本、以及Syt7 基因敲除小鼠进行细致分析,确认了Syt7表达在12个病人的干细胞分化神经元中显著下调、在病人血液中表达显著下调,并且Syt7 敲除小鼠大部分出现了躁狂抑郁情绪的昼夜循环,少部分表现为持续躁狂或持续抑郁,并且行为表型能够被临床药物治疗(图一C)。因而,Syt7所属的分子通路的缺陷很可能是双相情感障碍发病和遗传的关键所在。
本文在讨论部分指出,双相情感障碍家系研究发现该病的遗传率位居人类疾病前列,这与多基因致病假说存在根本性矛盾;作为多基因假说的主要证据,即遗传学动物模型的失败,尚有多基因之外的不同解释。例如:易感基因可能通过DNA-DNA远程相互作用影响远处靶基因的表达和功能,而非通过自身表达或功能异常来导致发病,然而动物种属间染色质结构的巨大差异,导致了无法在动物模型上模拟出人类细胞的这一变化。论文指出,这种可能性不仅在双相障碍中、而且在其它“多基因”精神疾病中同样可能存在。姚骏课题组2019年与美国加州大学旧金山分校的合作实验室发表的对人类诱导多能干细胞分化神经元进行染色质三维结构分析的论文,为这一假说提供了依据 (doi: 10.1038/s41588-019-0472-1)。
澳门尼斯人娱乐网站(中国)有限公司PI姚骏研究员和美国索尔克研究所的弗雷德?盖奇(Fred Gage)教授为本文共同通讯作者。姚骏研究员于2019年获Nature杂志评选的自然研究全球影响力奖入围奖。澳门尼斯人娱乐网站博士后沈伟、王秋文和博士生刘要南为本文共同第一作者。王秋文博士曾获2016年度中国石油奖学金和2017年度国家奖学金。广州脑科医院曹莉萍实验室、中科院北京基因组所米双利实验室、江苏省语言能力协同创新中心杨亦鸣教授、中科院心理所赵媚副研究员、澳门尼斯人娱乐网站(中国)有限公司隋森芳教授、钟毅教授和王宏伟教授、美国加州大学圣迭戈分校的约翰?凯素(John Kelsoe)教授、以及加拿大戴尔豪斯大学马丁?阿尔达(Martin Alda)教授为本项研究工作做出了重要贡献。本工作获得了膜生物学国家重点实验室、科技部重点研发专项、国家自然科学基金、江苏省语言能力协同创新中心以及公司—北大生命科学联合中心的经费支持。
原文链接: https://doi.org/10.1073/pnas.1918165117
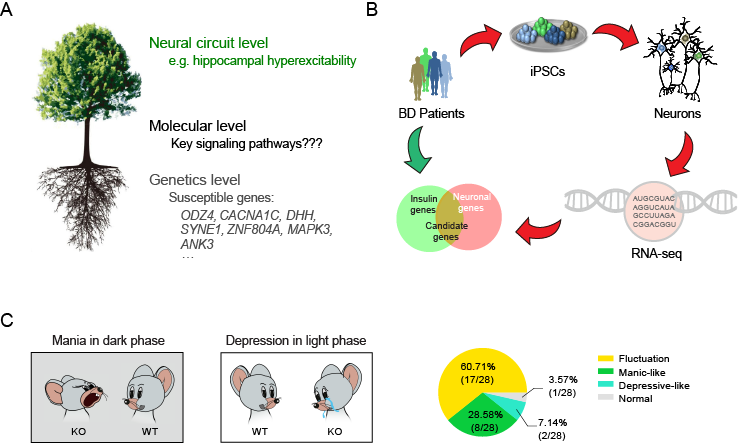
图一. BD发病的树状机理假说和基于并发症对比分析的疑似分子筛选