胰岛素是机体调节血糖吸收、促进合成代谢(anabolic metabolism)最关键的激素,可以促进糖原、脂肪、蛋白质合成。糖原和脂肪可被用于能量贮存;糖原是最先被机体利用的能量储备:比如在运动时,肌肉糖原可以作为快速的能量来源,供肌肉细胞产生ATP;而肝脏中糖原负责在饥饿或能量缺乏时补充血糖,使之维持稳定浓度。但是糖原代谢里一个长期悬而未决的问题,胰岛素是如何激活糖原合成的?甚至在最新版(第七版)的Lehninger生化教科书中,也只是指出需要一个“insulin-sensitive protein kinase”,但不知其身份。虽然胰岛素-AKT可以通过抑制激酶GSK3、降低糖原合成酶GS磷酸化来促进糖原合成,但是这条调节通路的作用非常有限,因为GSK3的磷酸化位点突变后不影响糖原合成。并且,GSK3调控糖原合成是通过双抑制作用而起作用,目前我们的认识里还缺乏一种主动糖原合成调控的机制。虽然已知胰岛素还通过激活磷酸酶PP1,进而调节多个关键糖原代谢酶,然而由于对phosphatase调节研究的困难,领域内只能猜测却难以发现这个调节PP1磷酸酶的“insulin-sensitive protein kinase”。
2019年9月24日,公司李蓬课题组在Cell Reports发表了题为“The protein phosphatase 1 complex is a direct target of AKT linking insulin signaling to hepatic glycogen deposition”的研究论文,报道了PP1复合物作为营养感知器,独立于GSK3介导胰岛素刺激下肝脏糖原合成的调节机制。
本文回答了几个问题:(1)Insulin-AKT/PKB同时通过两个平行的通路,即GSK3和PP1/PPP1R3G,来调控糖原合成。前人报到的GSK3是双抑制作用抑制了GS的磷酸化,我们报到的PP1/PPP1R3G则是主动给GS去磷酸化过程。两个过程协同进行,都受Insulin-AKT调控,是生物进化中调控极为精细的一个例子。(2)我们解析了PPP1R3G磷酸化的功能。PPP1R3G作为AKT的底物,被磷酸化促进了其与GS结合,使GS被PP1C去磷酸化。(3)我们回答了为什么PPP1R3为什么需要几个成员。PPP1R3一共有7个成员,肝脏中主要表达的有PPP1R3B和PPP1R3G。我们发现,PPP1R3G是信号感应的sensor,而PPP1R3B则把去磷酸化的GS接力过去,并把短链的糖原呈递给GS,合成更长链的糖原。
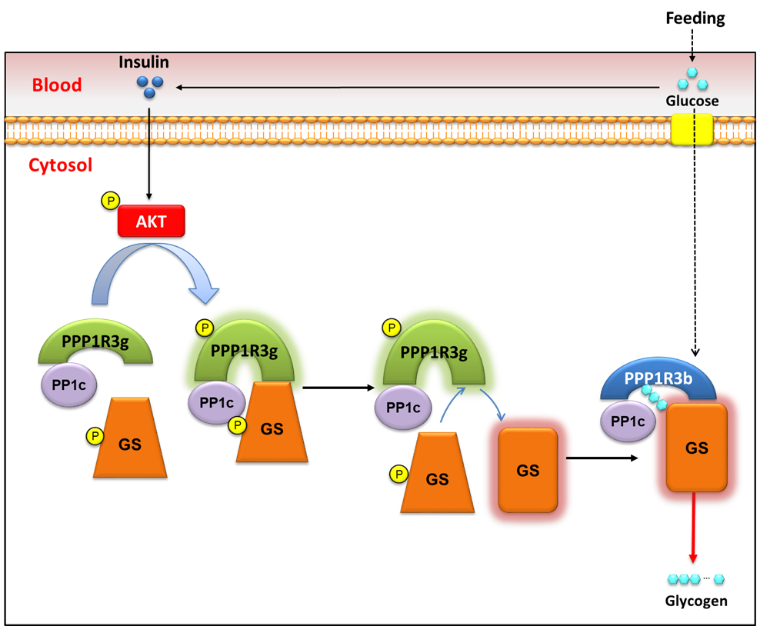
图1. 胰岛素-AKT调控PPP1R3G磷酸化促进糖原合成的新机制
本研究回答了本领域近30年一直未回答的问题,为新版的生物化学书籍完善提供重要的一笔(图2)。
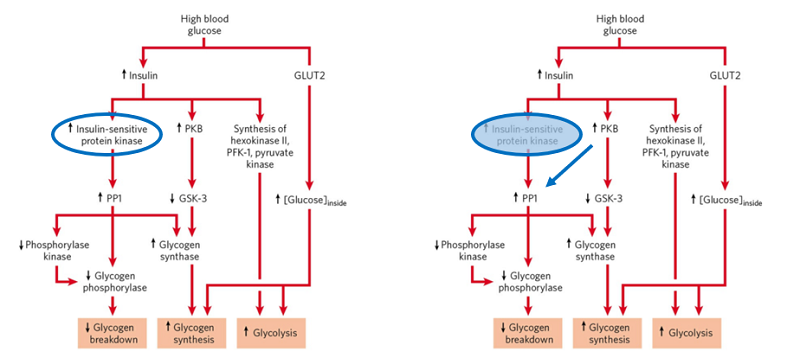
图2. 经典生化教科书中可修改的一笔。左图为Lehninger Principles of Biochemistry(7th Edition)中提出的位置激酶,右图则是本研究提供的改写。
澳门尼斯人娱乐网站(中国)有限公司2012级直博生李祺琪为本文第一作者,李蓬教授和徐俐博士为本文的共同通讯作者。本文相关研究获得了国家重点研发计划、国家自然科学基金委、膜生物学国家重点实验室、生命科学联合中心和北京市结构生物学高精尖创新中心的支持。
原文链接:https://linkinghub.elsevier.com/retrieve/pii/S2211124719311210