2019年4月10日,澳门尼斯人娱乐网站(中国)有限公司隋森芳教授研究组在《科学●进展》(Science Advances)期刊上在线发表题为"SNARE复合体解聚的机制研究"(Mechanistic insights into the SNARE complex disassembly)的研究论文,通过解析SNARE解聚分子机器20S复合体的高分辨率冷冻电镜三维结构,并结合生化实验、电生理实验和交联质谱实验,揭示了SNARE复合体的解聚机制。
膜融合是生命基本和重要的过程之一,真核细胞多种形式的胞内区间具有不同的生物化学性质,细胞维持这些胞内分区之间的动态平衡主要依赖的是囊泡转运,该过程与许多重要疾病密切相关。囊泡转运即包含转运物质的囊泡从供体出芽然后转移至目标膜,锚定之后与目标膜融合,从而使得膜蛋白、磷脂和内容物转运至另一个细胞区间。神经递质的释放就是通过突触囊泡与质膜的融合实现的。位于囊泡膜上的v-SNARE蛋白和位于目标膜上的t-SNARE蛋白在形成SNARE复合体的过程中将两膜拉近并驱动膜融合的发生。SNARE复合体是非常稳定的四螺旋束结构,必须被解聚成单体以便循环使用,在细胞内这是通过马达蛋白NSF及其接头蛋白SNAP共同完成的。NSF蛋白是一种多细胞功能相关的ATP酶(AAA+ ATPase),它与接头蛋白SNAP、SNARE复合体一起形成沉降系数为20S的复合体。在20S复合体中,NSF在SNAP的帮助下利用水解ATP产生的能量将SNARE复合体解开成单体,使胞内膜融合的过程得以循环进行。20S复合体是一个非常高效的分子机器,对其工作机制的研究不仅有助于深入理解胞内SNARE的循环利用机制及膜融合的调控机制,也对揭示AAA+ ATPase酶的分子机理具有重要的意义,因此一直是科学家们研究的热点问题。
隋森芳教授研究组长期致力于利用冷冻电镜技术研究与生物膜相关的重要蛋白复合体的结构与功能。此前,曾于2012年在《自然结构与分子生物学》(Nature Structural & Molecular Biology)期刊上报道了全长NSF蛋白在水解ATP过程中各个状态的三维结构以及20S复合体的负染电镜三维结构。随后,又于2015年在《细胞研究》(Cell Research)期刊上报道了20S复合体的低分辨率冷冻电镜三维结构和SNAP-SNARE亚组装体中等分辨率的结构,发现并验证了新的解聚关键氨基酸。在此次发表的《科学●进展》论文中,研究人员通过优化冷冻样品制备条件将锚定在纳米盘(Nanodisc,模拟细胞膜的脂质双分子层)上的20S复合体的分辨率推进至4.6  ,并进一步通过分割重构法将NSF六聚体和α-SNAP-SNARE亚组装体的分辨率提高到3.9
,并进一步通过分割重构法将NSF六聚体和α-SNAP-SNARE亚组装体的分辨率提高到3.9  和3.7
和3.7  (图1)。
(图1)。
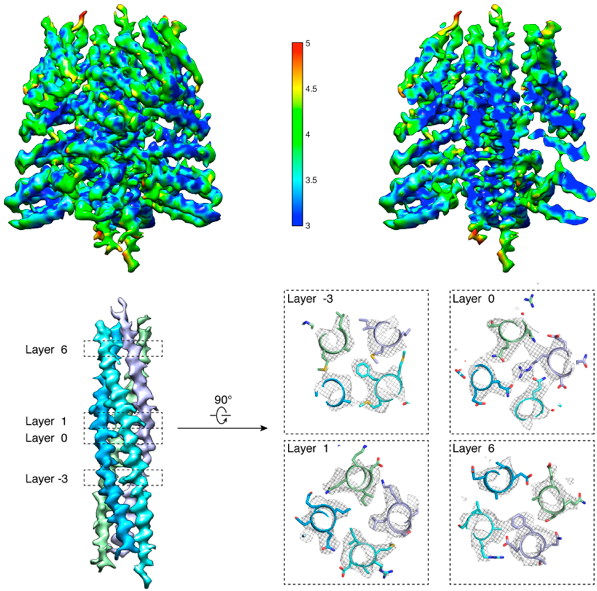
图1 α-SNAP-SNARE部分电镜结构的分辨率分布和典型氨基酸残基的密度图。
这些高分辨率结构揭示了20S复合物中蛋白质相互作用的许多细节。结合生化分析,研究者发现在SNARE解聚过程中,α-SNAPs主要通过R116残基的静电作用和L197残基的疏水作用对VAMP单链的两个位点施加作用力。为了进一步评价R116和L197在体内的功能相关性,研究者与澳门尼斯人娱乐网站(中国)有限公司姚骏老师课题组合作检测了这些突变体对培养的海马神经元释放神经递质的影响。结果表明,与野生型α-SNAP过表达相比,R116A和L197A显著降低了突触小泡的释放速度,表明这两个突变体可能通过降低SNARE复合物的解聚能力而显著削弱了膜融合(图2)。
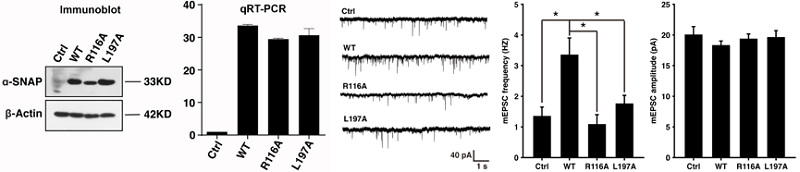
图2 电生理实验检测α-SNAP的R116残基和L197残基的功能。
此外结合交联质谱实验,研究者证明了SNARE螺旋束的氨基末端与NSF-D1结构域的中心孔环之间有直接相互作用,并验证了这种相互作用可能作为锚定支点在SNARE复合体的解聚中发挥重要作用。该研究提供了一个详细的α-SNAP介导的SNARE复合体解聚的旋转模型(图3):NSF利用ATP水解产生的能量带动α-SNAP圆筒沿右手方向旋转从而对SNARE复合体的左手方向螺旋束施加解旋方向的切线力——主要来自于α-SNAP蛋白的 R116残基与VAMP蛋白的E62和D68残基的静电作用以及α-SNAP蛋白的L197残基与VAMP蛋白的V48、V50和L54残基的疏水作用。同时由于SNARE复合物的N端直接锚定在NSF-D1的孔区,右手扭矩将开始展开和/或破坏左手螺旋的SNARE复合物,从而同时或连续地将复合物分解成单个蛋白质。
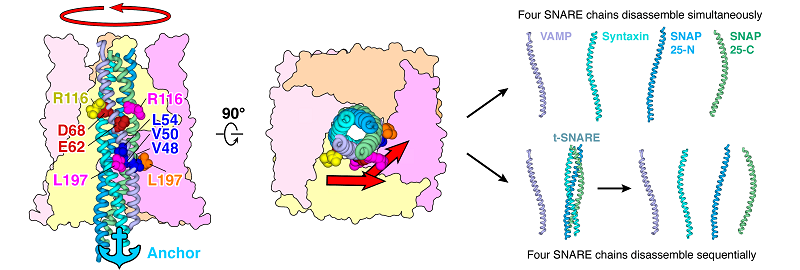
图3 SNARE复合体解聚的模型。
澳门尼斯人娱乐网站(中国)有限公司隋森芳教授为本文的通讯作者;澳门尼斯人娱乐网站已毕业博士生黄轩(现为首都医科大学附属北京朝阳医院医学研究中心研究实习员)、澳门尼斯人娱乐网站孙珊副研究员、澳门尼斯人娱乐网站已毕业博士生王霄婧、澳门尼斯人娱乐网站前助研樊凤辉为本文的共同第一作者。澳门尼斯人娱乐网站博士后周强(现为西湖大学特聘研究员)参与了电镜数据分析;澳门尼斯人娱乐网站姚骏课题组进行了电生理实验;北京生命科学研究所董梦秋研究员课题组进行了交联质谱的工作。国家蛋白质科学研究(北京)设施公司基地冷冻电镜平台和计算平台,以及公司高性能计算平台为数据收集和处理提供了支持。膜生物学国家重点实验室、北京市结构生物学高精尖创新中心、科技部、国家自然科学基金等为本研究提供了经费支持。
原文链接:https://advances.sciencemag.org/content/5/4/eaau8164