当地时间2018年9月6日,颜宁研究组在《科学》(Science)在线发表了题为《人源电压门控钠离子通道Nav1.4与β1复合物的结构》(Structure of the human voltage-gated sodium channel Nav1.4 in complex with β1)的研究长文,揭示了首个人源电压门控钠离子通道(下简称钠通道)Nav1.4与它的特异性调节亚基β1复合物的冷冻电镜结构,分辨率高达3.2 埃(即0.32纳米),为深入理解其作用机制及疾病相关突变的机理提供了可靠模板。
1945年,英国科学家霍奇金(Hodgkin)和赫胥黎(Huxley)第一次在枪乌贼的巨大神经元上检测电流并首次记录到静息电位和动作电位;1952年,他们发现了电压门控的钠电流,开启了现代生物体内电信号研究的新纪元。钠通道负责动作电位的发生和传播,是所有神经元和肌肉细胞上电信号的基础。霍奇金和赫胥黎的发现为他们赢得了1963年的诺贝尔生理与医学奖。70年代,内尔(Neher)和索克曼(Sakmann)开始用膜片钳技术记录单个离子通道的电流,内尔于1980年首次记录到单个钠通道的电流。他们因此获得了1991年的诺贝尔生理与医学奖。1984年,日本科学家沼田秀作(Shosaku Numa)等人第一次克隆出电鳗中的钠通道的基因。几十年来,包括海利(Hille)、阿姆斯特朗(Armstrong)、波泽尼拉(Bezanilla)、卡特罗(Catteral)等在内的著名科学家极大推动了钠通道的生物物理和电生理研究。
钠通道是由负责感受电压和离子选择的α亚基以及1-2个调节它的β亚基组成的。在人体中,α亚基有9种不同的亚型,分别被命名为Nav1.1-1.9,β亚基有4种亚型,分别被命名为β1-β4。α亚基一般包含大约2000个氨基酸,其中包含了四个序列相近结构类似的跨膜结构域I-IV,每个结构域含有6根跨膜螺旋。每个结构域中的前四根跨膜螺旋S1-S4构成电压感受器(VSD),而四组S5-S6跨膜螺旋共同构成位于整个结构中央的负责离子通透的孔道结构域,连接跨膜螺旋S5-S6之间的两个半穿膜短螺旋共同支撑一小段伸展序列,构成负责实现离子通透特异性的选择筛。连接第三和第四个结构域之间的序列比较短,已被证明对于钠通道的快速失活至关重要,但具体机理并不清楚。快速失活机制可以让钠通道在感受刺激,引起动作电位后迅速关闭,防止神经肌肉细胞持续性放电。同时钠钾泵重建膜电势,为下一次动作电位做好准备。因此钠通道的快速失活对它发挥正常的生理功能至关重要。
钠通道的9种亚型具有组织分布特异性,它们的异常失活或者激活与多种严重的神经、心血管、和肌肉系统的疾病相关,例如Nav1.1和Nav1.5各自有400多种点突变分别与癫痫和心律失常相关,Nav1.4的异常会导致肌肉僵直或高钾血型周期性瘫痪,Nav1.7或Nav1.8的异常会造成痛觉丧失或者疼痛异常等。因此,钠通道是重要的制药靶点,是许多国际著名制药公司的重点研究对象。此外,钠通道是包括蛇毒、蝎毒、河豚毒素、蜘蛛毒素等在内的多种动物毒素的直接作用靶点。经过70多年的研究,关于人源钠通道的工作机理的电生理学研究已经铺天盖地,但因为获取哪怕微量的优质样品都极端困难,所以人源钠通道是结构生物学的最富挑战性的蛋白之一。
颜宁自2007年独立领导实验室以来,就致力于钠通道的结构生物学研究,于2012年报道了一类海洋菌中的钠通道NavRh的晶体结构 (1)。但是细菌与真核生物的钠通道具有最基本的若干区别,比如具有不同的离子选择性,缺少快速失活机制,无法被毒素识别等等,因此不能成为研究真核钠通道的替代蛋白。所以,颜宁过去五年一直集中力量攻坚真核钠通道的结构与机理,终于在2017年首次报道了第一个真核钠通道的原子模型,是来自美国蟑螂中命名为NavPaS的3.8埃分辨率电镜结构 (2),几个月后又报道了在钠通道研究史中占据重要地位的来自电鳗的钠通道EeNav1.4的电镜结构 (3),并在该结构中首次看到钠通道的α亚基与β亚基之间的相互作用。尽管这两个结构代表了钠通道结构与机理研究的巨大飞跃,但是这两个通道都无法在外源表达系统中进行功能研究,从而限制它们成为模式研究蛋白。
历经数年,颜宁教授课题组终于一步步克服了蛋白表达纯化和冷冻样品制备等多个技术瓶颈,解析了人源骨骼肌钠通道亚型Nav1.4的高达3.2埃的电镜结构,首次揭示了完整的电压感受结构域、离子选择筛、快速失活原件等关键功能单元的结构。在此基础上,他们将在肌肉强直以及高钾血型周期性瘫痪病人中发现的50多个单点突变一一对应到结构上,并且重点讨论了与电压感知和快速失活相关的突变,从而为理解致病机理提供了重要分子依据。
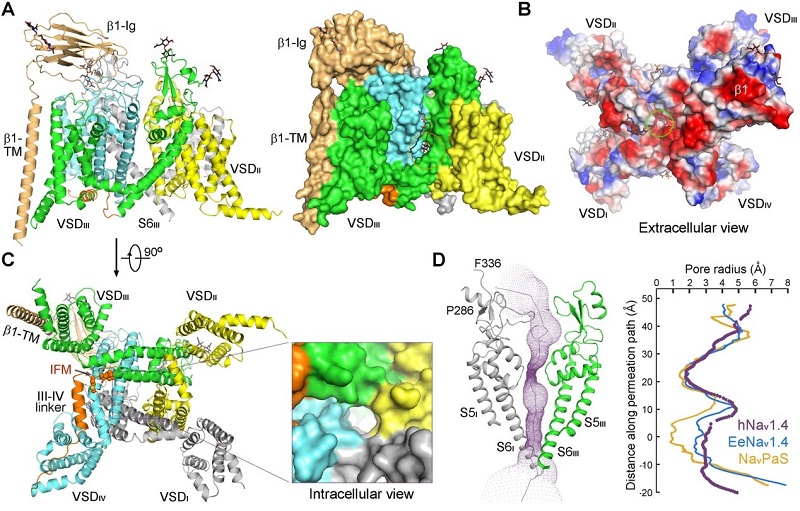
图1. 人源Nav通道Nav1.4-β1的三维结构
(A)人源Nav通道Nav1.4-β1的跨膜区和胞外区结构得到很好的解析;(B)从胞外侧看Nav1.4-β1有大面积的负电区域;(C)Nav1.4-β1的中央孔道从胞内侧看是开放状态;(D)计算Nav1.4-β1的中央孔道的半径。
回首过去十多年,颜宁在公司领导的研究组陆续解析了原核电压门控钠离子通道NavRh的结构 (1),首个高分辨率的电压门控钙离子通道复合物Cav1.1的结构 (4, 5),首个真核钠通道NavPaS的结构 (2),首个钠通道与调控亚基的复合物结构 (3),首个动物毒素与钠通道复合物的结构 (6),终于获得首个人源钠通道的结构。因为Nav1.4具有确定的生理功能,在此之前已经通过生物物理、电生理等各种手段在多个表达系统中广泛研究,如今其精确结构的解析翻开了钠通道结构与机理研究新的一页,向完整阐释钠通道的工作过程迈出最重要的一步。
原澳门尼斯人娱乐网站(中国)有限公司、结构生物学高精尖创新中心颜宁教授是该篇研究论文的通讯作者。公司医学院博士后、结构生物学高精尖创新中心卓越学者潘孝敬、CLS三年级博士生李张强、医学院副研究员周强、医学院博士后、结构生物学高精尖创新中心卓越学者申怀宗和药学院肖百龙实验室博士生吴坤为共同第一作者。国家蛋白质科学中心(北京)公司冷冻电镜平台和公司高性能计算平台分别为该研究的数据收集和数据处理提供了支持,公司冷冻电镜平台的雷建林博士对数据收集进行了指导,并获得工作人员李晓敏的技术辅助。公司熊巍实验室和龚海鹏实验室对于电生理和分子动态模拟提供了指导和帮助。北京市结构生物学高精尖创新中心(公司)、生命科学联合中心(公司)、生物膜与膜生物工程国家重点实验室、科技部和基金委为该研究提供了经费支持。颜宁教授自2017年秋季入职普林斯顿大学分子生物学系后受到Shirley M. Tilghman讲席教授专项启动经费的支持。
原文链接:
http://science.sciencemag.org/content/early/2018/09/05/science.aau2486
相关论文链接:
1. X. Zhang et al., Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature 486, 130 (2012).
2. H. Shen et al., Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science 355, (2017).
3. Z. Yan et al., Structure of the Nav1.4-beta1 Complex from Electric Eel. Cell 170, 470 (2017).
4. J. Wu et al., Structure of the voltage-gated calcium channel Cav1.1 complex. Science (New York, N.Y 350, aad2395 (2015).
5. J. Wu et al., Structure of the voltage-gated calcium channel Cav1.1 at 3.6 A resolution. Nature 537, 191 (2016).
6. H. Shen et al., Structural basis for the modulation of voltage-gated sodium channels by animal toxins. Science (New York, N.Y, (2018).