2017年11月6日,澳门尼斯人娱乐网站(中国)有限公司,结构生物学高精尖创新中心柴继杰教授研究组在《自然通讯》 (Nature Communications) 杂志发表研究论文,题目为“Structural basis for receptor recognition of pollen tube attraction peptides” (花粉管吸引小肽与受体识别的结构基础)。该论文通过严格的体外生化实验,表明在拟南芥物种中,亮氨酸丰富重复基序型受体激酶 (LRR-RK) PRK6可以直接与花粉管吸引小肽LURE产生高亲和力的特异性相互作用。并通过解析AtLURE1.2-AtPRK6LRR复合物的结构,从原子水平阐明了PRK6受体激酶C末端识别LURE吸引肽的结构基础。该研究为PRK6作为LURE小肽的直接受体提供了证据,为更好地理解花粉管吸引的分子机制提供了线索。
在高等开花植物的繁殖中,受精过程是最为关键的一个环节,受到了复杂且精细的调控。不具有移动能力的精细胞依赖于花粉管的运送,最终在雌配子体实现成功受精。其中,日本名古屋大学Tetsuya Higashiyama教授研究组2009年在《自然》发文揭示了由助细胞分泌产生的 LURE小肽在花粉管的珠孔吸引中起到了关键作用。在2016年,两个研究组分别在《自然》杂志报导了识别LURE的不同受体。
柴继杰教授研究组长期开展植物受体激酶的结构生物学研究,致力于解决重要植物受体激酶的识别和激活机制,在植物激素、根发育、气孔发育、免疫及自交不亲和领域做出了重要贡献。在此次发表的《自然通讯》论文里,柴继杰教授研究组解决了LURE小肽的“粘性”问题,用多种生化验证方法证明了LURE小肽在体外能特异性地与PRK6蛋白胞外域产生互作。并依靠晶体衍射的方法获得了该复合物1.85?的三维结构,发现PRK6蛋白LRR结构域的C末端环状结构是识别LURE小肽的重要区域,包含三个重要互作界面和多个介导互作的关键位点。通过与名古屋大学的Higashiyama教授研究组合作,这些关键位点的半体内功能验证实验与结构预测相符合。
澳门尼斯人娱乐网站(中国)有限公司结构生物学高精尖中心柴继杰教授和韩志富副研究员,以及日本名古屋大学Tetsuya Higashiyama教授为本文的共同通讯作者;澳门尼斯人娱乐网站(中国)有限公司已毕业博士生张晓骁、刘维佳和名古屋大学Takuya T. Nagae作为本文的共同第一作者。本课题得到了国家自然科学基金重点项目、国际合作与交流项目基金,以及公司结构生物学高精尖创新中心、公司-北大生命科学联合中心等资助,并得到国家蛋白质科学研究(北京)设施公司基地和上海同步辐射光源的大力支持。
论文连接:http://www.nature.com/articles/s41467-017-01323-8
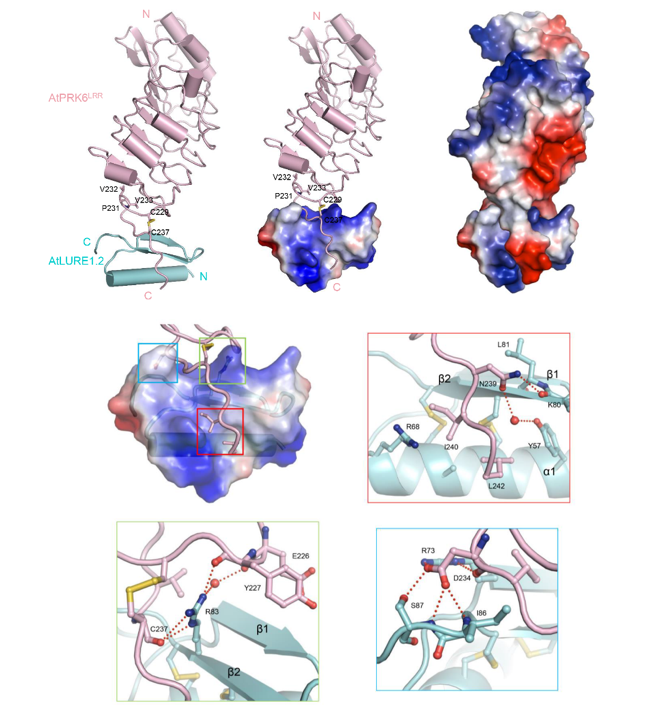
图为AtLURE1.2-AtPRK6LRR复合物的整体结构(上)和识别分子机制(下)