神经元之间的信号传递是大脑最基础的生理活动,当动作电位到达突触时,突触小泡在毫秒级的时间内释放神经递质,从而使动作电位快速跨突触传递,这一过程受到特定蛋白质机器的精密调控。突触小泡与质膜的融合可分为停泊(Docking)、点火(Priming)和融合(Fusion)三个过程。停泊作为囊泡融合的起始阶段,其重要意义在于大脑的神经活动并不是以单个的动作电位发生的,而是以十分高频率的一串动作电位的方式进行,这就要求突触有一批能快速释放的囊泡在时刻准备着。囊泡的即刻可释放池(RRP)保障了这一功能,并作为决定突触强度的首要因素,影响着神经元和大脑许多重要的功能,而停泊这一过程是囊泡进入即刻可释放池的初始步骤,其如何发生、由谁介导,目前尚无定论。
在文献报道中,Synaptotagmin-1 (Syt1)和三个SNARE蛋白形成的复合物,是介导突触小泡停泊的潜在候选分子机器。SNARE 复合物由三个蛋白组成,是囊泡与质膜融合的最小蛋白机器。Syt1则是动作电位诱发突触小泡释放的钙离子感受器。在经典的囊泡融合模型中,三个SNARE蛋白在远端结合形成一个Z字型的拉链,随着4个平行α螺旋束结构的形成,囊泡自远而近地完成了停泊-点火(Docking-Priming)的过程,进入准备释放(release ready)的状态,这是囊泡停泊的传统模型,即SNARE complex介导了囊泡的停泊。然而,这一模型存在较大争议,原因在于两方面。一方面,停泊的形态学定义(即囊泡须紧贴于质膜)并不准确,停泊究竟在什么位置启动,一直是悬而未决的问题。另一方面,在蛋白机器研究上,多重基因敲除动物模型不但耗时耗力,而且存在很多发育缺陷与代偿作用带来的负面效应。
为解决上述技术障碍,姚骏课题组开发了在体高效沉默多重基因的CRISPRi技术,在神经元中,高效特异地对基因单独或者联合进行条件性敲低,在神经元内构建出类体外重构的环境。另外,课题组结合高压冷冻(High pressure freezing)与电子断层扫描(TEM tomography)技术,得到接近真实状态下神经元突触不同基因敲除的三维电镜数据。从而对突触小泡的停泊过程进行精确的电镜观测和定义。作者首先对SNARE复合物进行了多重敲低,发现在离突触前膜2-12 nm的范围内,突触小泡出现了数倍于对照组的聚集。在SNARE 全敲的基础上引入Syt1敲低后,突触小泡的聚集现象消失,这说明Syt1可能是将囊泡圈定在2-12 nm范围内的关键因素。随后的一系列实验全面证实了Syt1的这一功能。进一步,作者们开始探索Syt1 启动突触囊泡停泊的分子伴侣。脂质体共沉淀实验(co-sedimentation)表明,Syt1 可以通过其C2B domain 上的K325-K327模块与PIP2结合,突变这一模块(Syt1KA),Syt1则无法与PIP2相互作用。而Syt1与SNARE结合有两个界面,同时突变这些界面位点(Syt1Q/LLQQ),可以有效地减弱Syt1与SNARE的结合。作者发现,在Syt1/SNARE敲低组中引入Syt1KA突变体,并不能让突触小泡被圈定在2-12 nm 范围内,而Syt1Q/LLQQ却可以执行这一功能。所以,Syt1很可能通过与PIP2结合来启动突触小泡停泊。针对PIP2的功能研究,作者们使用了四种不同的方法来降低或提升突触前膜上PIP2的含量,包括PIP2合成酶PIP5K三个亚型的三重敲降、PIP2水解酶Synaptojanin-1 (Synj)的增强型突变,以及代谢型谷氨酸受体mGluN5的拮抗剂和激动剂处理。这四种方法均有效地改变了突触前膜上PIP2的含量。此外,电镜分析结果表明,降低PIP2含量可抑制Syt1在2-12 nm处启动突触小泡的停泊,而提升PIP2含量则无明显效应。这一系列实验,证明了PIP2是Syt1在膜上的分子伴侣,它们相互作用、共同启动了突触小泡的Docking。
综合来看,本项研究发现Syt1结合PIP2介导了突触小泡的停泊的起始过程,其作用位置位于距质膜约12 nm处, 该过程不依赖于SNARE 复合物,且优先于SNARE 复合物的形成。通过这一研究,作者们发现了Docking起始态发生的位置和分子机制,为理解神经递质的释放过程,尤其是理解大脑在受到高频生理刺激时神经元保持快速高效的响应,做出了重要贡献。
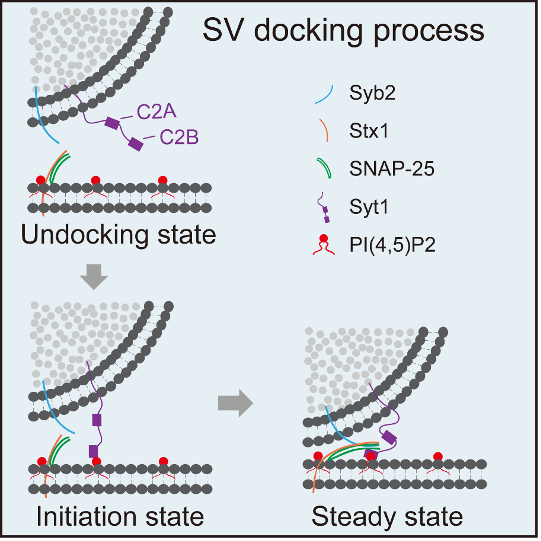
图一 突触囊泡Docking的动态过程及其分子机制
此研究工作于2021年3月16日在线发表于Cell Reports杂志。澳门尼斯人娱乐网站(中国)有限公司姚骏研究员为本文的通讯作者。澳门尼斯人娱乐网站博士生陈运、王颖菡及澳门尼斯人娱乐网站已出站博士后郑毅为共同第一作者。澳门尼斯人娱乐网站(中国)有限公司李雪明研究员及其实验室李美静博士,姚骏课题组王秋文博士、博士生汪兵、付崇雷、刘要南为本项研究工作做出了重要贡献。公司冷冻电镜平台李英博士和胡晓风、细胞影像平台王文娟博士、NIBS何万中研究员和尼康公司李勋博士为本研究提供了重要帮助。
全文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00156-X