生物在与病原微生物长期竞争中进化出了复杂完善的免疫系统,其功能可进一步分为先天性免疫和适应性免疫两部分。先天性免疫系统是宿主防御感染机制中一种普遍而古老的形式,它对于病原体的感知主要是通过一系列胚系基因编码的模式识别受体来实现。其中NOD样受体(NLR)家族是模式识别受体中数量最大、功能最复杂的一类,其通过不同成员来感应多样的病原信号,进而形成炎症小体来活化机体免疫防御反应。同时机体也通过精细的网络来调控各种NLR的时空表达、免疫反应的强弱来维持机体的内稳态,NLR的突变或失调经常导致各种免疫性相关疾病。
NLRP1作为NLR家族中的一员,NLRP1炎症小体也是人们发现的第一个NLR炎症小体,其突变常见于白癜风等皮肤免疫性疾病中。NLRP1不仅含有NLR家族蛋白典型的NOD、LRR和CARD等结构域,同时还具备独特的具有自切割功能的FIIND结构域,其自切割是NLRP1激活所必需(图1a)。最新研究表明二肽基肽酶DPP8/9可以抑制NLRP1的活化,但是DPP8/9介导的NLRP1抑制机制目前仍然不是很清楚。
2021年3月17日,澳门尼斯人娱乐网站(中国)有限公司柴继杰课题组和新加坡南洋理工大学医学院钟雷课题组合作,在《自然》(Nature)杂志在线发表了题为“DPP9抑制NLRP1的结构与生化机制研究”(Structural and biochemical mechanisms of NLRP1 inhibition by DPP9)的研究论文,通过结构生物学、生物化学和细胞生物学等手段阐明了DPP9介导的NLRP1抑制机制并对NLRP1炎症小体的激活机制提供了新的启示,加深了我们对NLR家族功能机制多样性的认识,也为相关免疫疾病的治疗提供了理论基础。
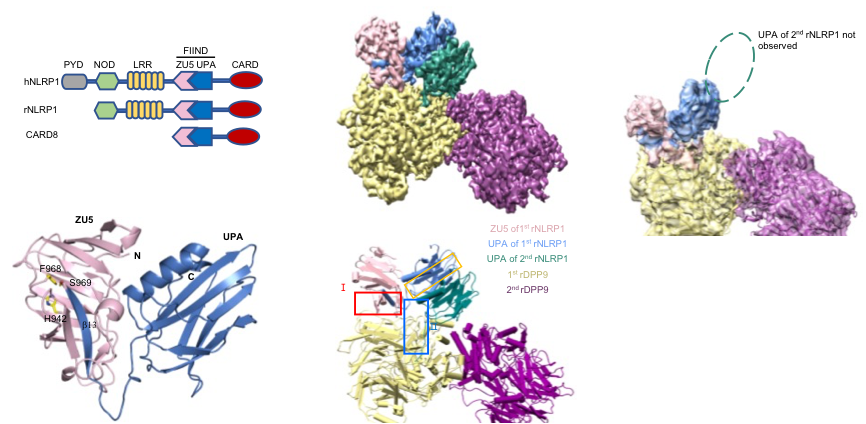
图1 NLRP1 FIIND 结构域结构以及全长NLRP1-DPP9 2:1复合体结构。
柴继杰团队首先解析了大鼠NLRP1 FIIND结构域的晶体结构(图1b),揭示了FIIND结构域发生自切割的关键氨基酸及催化机制,并发现ZU5亚结构域对于维持NLRP1的自抑制具有重要的作用。随后该团队又获得了大鼠全长NLRP1-DPP9复合体的高分辨率电镜结构(图1c-d)。出乎意料的是,电镜结构显示NLRP1与DPP9形成了2:1复合体,而且其中的两个NLRP1分子一个是全长,另一个仅包括自切割后的C末端片段。随后通过与新加坡南洋理工大学医学院钟雷课题组和吴彬课题组合作,通过大量的生化及细胞试验揭示了DPP9的结合及酶活功能对于维持体内NLRP1的抑制活性都是必需的。本研究不仅揭示了DPP9维持NLRP1自抑制的重要功能,为开发相关的免疫疾病药物提供了坚实基础;同时我们的研究也提示了NLRP1-DPP9的2:1复合体可能是体内NLRP1感应各种病原或内源信号发挥功能的真实状态(图2),为未来深入研究其机理提供了基础。
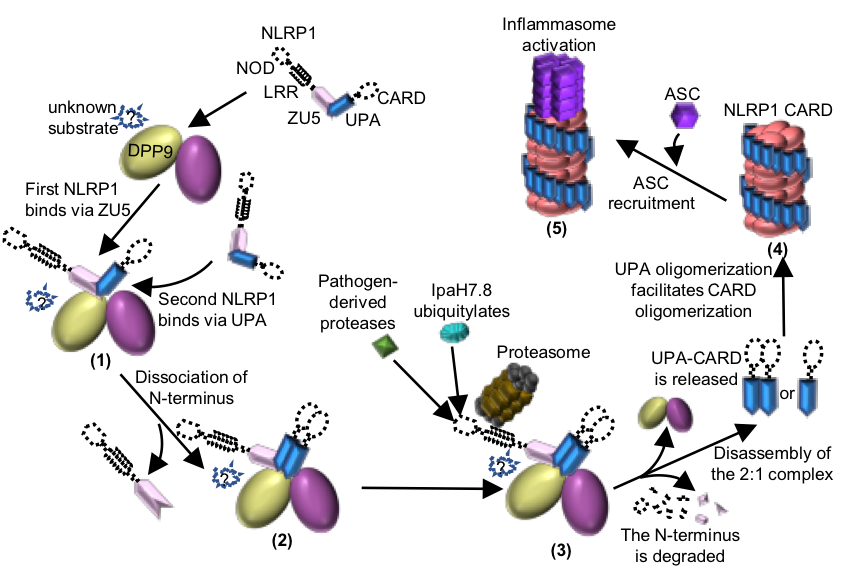
图2 DPP9介导的NLRP1抑制机制以及病原体诱导的NLRP1活化机制模式图。
澳门尼斯人娱乐网站(中国)有限公司柴继杰教授、新加坡南洋理工大学医学院钟雷助理教授为本论文共同通讯作者。澳门尼斯人娱乐网站(中国)有限公司博士后、公司结构生物学高精尖创新中心卓越学者黄梦杭,原公司结构生物学高精尖创新中心卓越学者、澳门尼斯人娱乐网站(中国)有限公司已出站博士后张晓骁为本文的共同第一作者。南洋理工大学医学院的卓己安,南洋理工大学生物科学学院吴彬助理教授、龚琴, 澳门尼斯人娱乐网站(中国)有限公司副研究员韩志富博士,澳门尼斯人娱乐网站(中国)有限公司助理研究员王家博士也为本研究做出了重要贡献。Bruno Reversade博士研究团队在研究、技术上给予了帮助支持。公司冷冻电镜平台的雷建林博士、李晓敏博士对冷冻电镜数据收集进行了指导和帮助。公司生命科学院高精尖创新中心X-ray主管范仕龙博士对晶体数据收集进行了指导和帮助。国家蛋白质科学中心(北京)、公司冷冻电镜平台、公司高性能计算平台和上海同步辐射光源为本研究提供了设备和技术支持。本研究得到了国家自然科学基金、北京结构生物学高精尖创新中心、公司-北大生命科学联合中心、亚历山大-冯-洪堡基金会、马克斯-普朗克学会、新加坡卫生部、新加坡国家研究基金会奖学金的经费支持。
论文链接:https://www.nature.com/articles/s41586-021-03320-w