构成生命的天然核酸和天然蛋白质皆具有手性单一特性:已知的天然核酸皆由D型核糖组成,天然蛋白质几乎皆由L型氨基酸组成。澳门尼斯人娱乐网站(中国)有限公司朱听课题组致力于从遗传信息中心法则出发,利用化学、生物学等多学科手段构建与天然生物分子手性相反的“镜像生物学系统”。至今,该课题组已初步实现了镜像中心法则中的镜像核酸复制、转录、反转录等过程,开发了镜像PCR、镜像核酸测序等技术,目前正在着力构建镜像蛋白质翻译系统以实现完整的镜像中心法则,并尝试拓展镜像生物学系统的实际应用。
人类社会高速发展带来的海量信息使传统磁、光介质的信息存储能力受到巨大挑战。DNA因具有信息存储密度高、保存时间长等优点,有望成为新一代信息存储介质。目前,DNA信息存储技术均以天然DNA为介质,而天然DNA极易被自然环境中的微生物及核酸酶降解,不利于在开放环境中长时间稳定存放。与天然DNA手性相反的镜像DNA不仅具有相同的高信息存储密度,还具有独特的生物正交性,不易被微生物及核酸酶降解。与天然DNA信息存储技术相同,镜像DNA信息存储技术主要包括信息的“写入”与“读取”两个过程,需要高保真镜像DNA聚合酶来帮助实现。然而,受限于已有的蛋白质与核酸化学合成技术,分子量在50 kDa以上的大型镜像蛋白质和长度在150 bp以上的长链镜像DNA的有效合成一直未能实现,长期制约着镜像生物学领域的发展及该系统的实际应用。
通过近五年的研究探索,朱听课题组全化学合成了分子量达90 kDa的大型镜像蛋白质:镜像Pfu DNA聚合酶,利用该高保真镜像聚合酶组装出千碱基长度的长链镜像DNA,并开发了基于镜像DNA的信息存储技术。该研究成果以“利用高保真镜像Pfu DNA聚合酶实现生物正交的镜像DNA信息存储”(Bioorthogonal information storage in L-DNA with a high-fidelity mirror-image Pfu DNA polymerase)为题,于2021年7月29日发表在Nature Biotechnology杂志(论文链接:https://www.nature.com/articles/s41587-021-00969-6)。
为突破全化学合成对蛋白质大小的限制,研究者提出利用分割蛋白质设计辅助合成的策略,将全长为775个氨基酸的Pfu DNA聚合酶分割为长度为467个氨基酸和308个氨基酸的两个片段分别合成,将其混合后共同复性,使其正确折叠为具有完整功能的90 kDa高保真镜像Pfu DNA聚合酶(图1),为目前已报道最大的全化学合成蛋白质;研究者还利用该高保真镜像聚合酶组装出长达1.5 kb的镜像16S核糖体RNA基因,为目前已报道最长的镜像DNA。该实验中首次使用的大型镜像蛋白质全化学合成策略及千碱基长度镜像基因的组装技术,解决了长期制约镜像生物学领域发展的大型镜像生物分子的制备难题,为后续构建镜像蛋白质翻译系统以实现完整的镜像中心法则及拓展镜像生物学系统的实际应用奠定了基础。
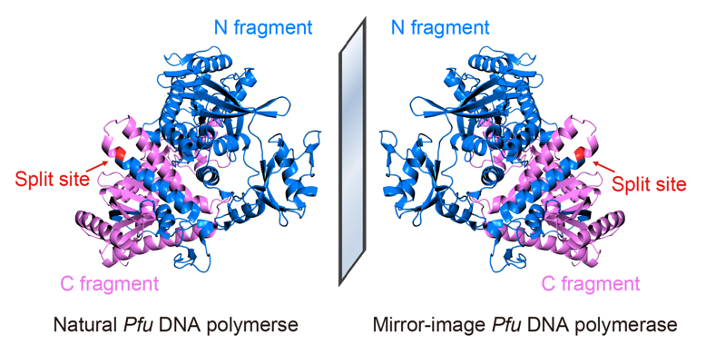
图1:利用分割蛋白质设计辅助合成镜像Pfu DNA聚合酶
同时,研究者还开发了基于镜像硫代磷酸DNA的镜像DNA边合成边测序技术。相比于该课题组此前开发的镜像DNA化学测序,新技术在测序读长、准确性、可操作性等方面都具有明显优势。上述高效、高保真的镜像DNA序列组装与扩增系统,结合简便实用的镜像DNA测序技术,为实现镜像DNA信息存储创造了条件。研究者将巴斯德于1860年首次提出“镜像生物学世界”这一概念的文字转换为碱基序列写入镜像DNA文库中,并从镜像DNA中准确读取了该文本信息,从而实现了镜像DNA信息存储(图2)。巴斯德的经典文献也成为了首段被存入镜像DNA的信息。
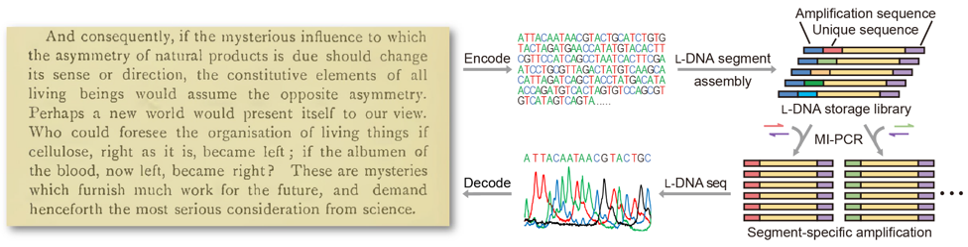
图2:镜像DNA信息存储
研究者还利用环境水样进行了生物正交性实验,结果表明携带采样地点信息的镜像DNA在从公司园荷塘采集的水样中存放一年后仍能被有效扩增,且其携带的信息仍能被准确读取;而同样存放条件下的天然DNA则在一天后即被完全降解,造成信息丢失(图3)。该实验展示了镜像DNA在复杂自然环境中长时间储存信息的能力及广泛的适用性。
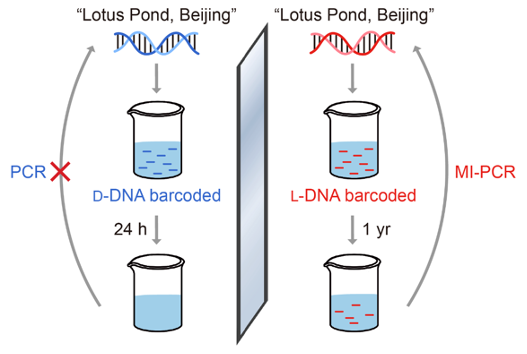
图3:镜像DNA在环境水样中长时间储存信息
此外,研究者还进一步开发了基于镜像DNA的信息隐写技术:将加密信息的密钥写入镜像DNA并混入天然DNA文库,使用天然DNA扩增与测序技术仅能读取天然DNA中的错误密钥,导致解码错误信息;只有使用镜像DNA扩增与测序技术才能读取镜像DNA中的正确密钥并解码加密信息(图4)。基于镜像DNA的信息隐写技术可以有效提高DNA所携带信息的保密性,为镜像生物学系统在信息安全领域的应用提供了新的思路。
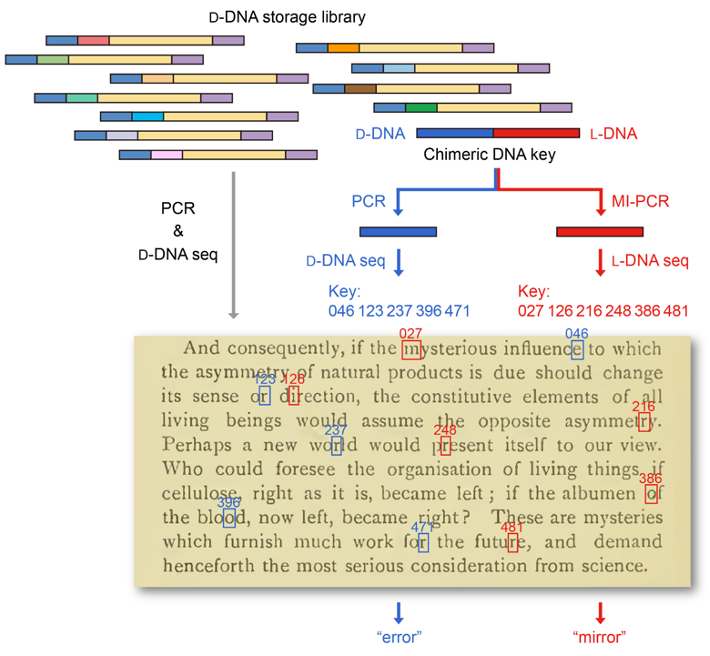
图4:基于镜像DNA的信息隐写技术
澳门尼斯人娱乐网站(中国)有限公司、公司-北大生命科学联合中心博士生范楚珧、邓强为该论文共同第一作者,澳门尼斯人娱乐网站(中国)有限公司朱听教授为通讯作者。该研究获得了国家自然科学基金委、公司-北大生命科学联合中心、腾讯基金会、公司结构生物学高精尖创新中心和北京生物结构前沿研究中心的资助。
相关论文:http://zhulab.life.tsinghua.edu.cn/publications.html